কোবাল্ট
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| পরিচয় | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| নাম, প্রতীক | কোবাল্ট, Co | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| উচ্চারণ | /ˈkoʊbɒlt/ KOH-bolt | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| উপস্থিতি | hard lustrous gray metal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| পর্যায় সারণীতে কোবাল্ট | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| পারমাণবিক সংখ্যা | 27 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| আদর্শ পারমাণবিক ভর | 58.933195(5) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| মৌলের শ্রেণী | transition metal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| শ্রেণী, পর্যায়, ব্লক | ৯, পর্যায় ৪, d-ব্লক | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
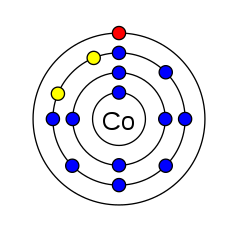
| ইলেকট্রন বিন্যাস | [Ar] 4s2 3d7 per shell: 2, 8, 15, 2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ভৌত বৈশিষ্ট্য | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| বর্ণ | ধাতব ধুসর | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| গলনাঙ্ক | 1768 কে (1495 °সে, 2723 °ফা) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| স্ফুটনাঙ্ক | 3200 K (2927 °সে, 5301 °ফা) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ঘনত্ব (ক.তা.-র কাছে) | 8.90 g·cm−৩(০ °সে-এ, ১০১.৩২৫ kPa) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| তরলের ঘনত্ব | m.p.: 7.75 g·cm−৩ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ফিউশনের এনথালপি | 16.06 kJ·mol−১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| বাষ্পীভবনের এনথালপি | 377 kJ·mol−১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| তাপ ধারকত্ব | 24.81 J·mol−১·K−১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
বাষ্প চাপ
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| পারমাণবিক বৈশিষ্ট্য | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| জারণ অবস্থা | 5, 4 , 3, 2, 1, -1 amphoteric oxide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| তড়িৎ-চুম্বকত্ব | 1.88 (পলিং স্কেল) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| আয়নীকরণ বিভব |
(আরও) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| পারমাণবিক ব্যাসার্ধ | empirical: 125 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| সমযোজী ব্যাসার্ধ | 126±3 (low spin), 150±7 (high spin) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| বিবিধ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| কেলাসের গঠন | hexagonal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| শব্দের দ্রুতি | পাতলা রডে: 4720 m·s−১ (at 20 °সে) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| তাপীয় প্রসারাঙ্ক | 13.0 µm·m−১·K−১ (২৫ °সে-এ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| তাপীয় পরিবাহিতা | 100 W·m−১·K−১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| তড়িৎ রোধকত্ব ও পরিবাহিতা | ২০ °সে-এ: 62.4 n Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| চুম্বকত্ব | ferromagnetic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ইয়ংয়ের গুণাঙ্ক | 209 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| কৃন্তন গুণাঙ্ক | 75 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| আয়তন গুণাঙ্ক | 180 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| পোয়াসোঁর অনুপাত | 0.31 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (মোজ) কাঠিন্য | 5.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ভিকার্স কাঠিন্য | 1043 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ব্রিনেল কাঠিন্য | 700 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ক্যাস নিবন্ধন সংখ্যা | 7440-48-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| সবচেয়ে স্থিতিশীল আইসোটোপ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| মূল নিবন্ধ: কোবাল্টের আইসোটোপ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
কোবাল্ট একটি রাসায়নিক উপাদান যার প্রতীক ‘Co’ এবং পারমাণবিক সংখ্যা ২৭। নিকেলের মতো কোবাল্টও কেবল রাসায়নিকভাবে যুগ্ম অবস্থায় ভূত্বকে পাওয়া যায়। প্রাকৃতিকভাবে সংকরিত ক্ষণপ্রভ লোহাতে সঞ্চিত অবস্থাতেও পাওয়া যায়। হ্রাসকারী বিগলন দ্বারা উৎপাদিত মুক্ত কোবাল্ট একটি শক্ত, উজ্জ্বল ও রূপালি-ধূসর ধাতু।কোবাল্ট ভিত্তিক নীল রঞ্জক (কোবাল্ট ব্লু) প্রাচীনকাল থেকেই গহনা, রং এবং গ্লাসে একটি স্বতন্ত্র নীলচে আভা ফুটিয়ে তোলার জন্য ব্যবহৃত হচ্ছে। তবে রংটি ধাতব বিসমাথের কারণে বলে মনে করা হত। খনি শ্রমিকরা দীর্ঘদিন ধরে নীল-রঞ্জক উৎপাদনকারী খনিজগুলিকে ‘কোবোল্ড (Kobold) আকরিক’ বলে আসছিলেন। পরিচিত ধাতুগুলোর মধ্যে নগণ্য হওয়ায় এবং বিগলনে বিষাক্ত আর্সেনিকযুক্ত ধোঁয়া দেয় বলে এদের এমন নামকরণ করা হয়েছিল। ১৭৩৫ সালে, এই আকরিকগুলি থেকে হ্রাসযোগ্য পদ্ধতিতে একটি নতুন ধাতু আবিষ্কৃত হয়। যা শেষ পর্যন্ত কোবোল্ডের জন্য নামকরণ করা হয়েছিল।
এখন কিছু কোবাল্ট কোবাল্টাইট (CoAsS) এর মতো ধাতব-উজ্জ্বল আকরিকগুলি থেকে উৎপাদিত হয়। যদিও সাধারণত উপাদানটি তামা এবং নিকেল খনির উপজাত হিসেবেই বেশি উৎপাদিত হয়। গণতান্ত্রিক কঙ্গো প্রজাতন্ত্রের (ডিআরসি) এবং জাম্বিয়ার কপারবেল্ট অঞ্চল বিশ্বব্যাপী বেশিরভাগ কোবাল্ট সরবরাহ করে। কানাডিয়ান প্রাকৃতিক সংস্থা অনুসারে, ২০১৬ সালে ডিআরসি এককভাবে বিশ্ব উৎপাদনের ৫০% (১২৩,০০০ টন) এরও বেশি কোবাল্ট উৎপাদন করে।
কোবাল্ট মূলত চৌম্বকীয়, পরিধান-প্রতিরোধী এবং উচ্চ-শক্তিসম্পন্ন সংকর তৈরিতে ব্যবহৃত হয়। যৌগিক কোবাল্ট সিলিকেট এবং কোবাল্ট(II) এলুমিনেট (CoAl2O4, কোবাল্ট ব্লু) কাঁচ, সিরামিক, কালি, রং এবং বার্নিশে একটি স্বতন্ত্র নীলচে আভা ফুটিয়ে তোলে। কোবাল্টের একটিমাত্র স্থিতিশীল আইসোটোপ, কোবাল্ট-৫৯ বিদ্যমান। কোবাল্ট-৬০ হল বাণিজ্যিকভাবে গুরুত্বপূর্ণ তেজস্ক্রিয় আইসোটোপ যা তেজস্ক্রিয় ট্রেসার হিসাবে এবং উচ্চ শক্তির গামা রশ্মি উৎপাদনের জন্য ব্যবহৃত হয়।
কোবাল্ট হল কোবালামিন গ্রুপের কোএনজাইম গুলোর সক্রিয় কেন্দ্র। ভিটামিন বি12, যার সর্বাধিক পরিচিত উদাহরণ। এটি সমস্ত প্রাণীর জন্য একটি প্রয়োজনীয় ভিটামিন। অজৈব কোবাল্ট ব্যাকটেরিয়া, শ্যাওলা এবং ছত্রাকের জন্যও একটি মাইক্রোনিউট্রিয়েন্ট।
বৈশিষ্ট্য
কোবাল্ট একটি ফেরোচৌম্বক পদার্থ, যার আপেক্ষিক গুরুত্ব ৮.৯। কুড়ি তাপমাত্রা ১,১১৫° সেলসিয়াস (২,০৩৯° ফারেনহাইট) এবং চৌম্বক ভ্রামক প্রতি পরমাণুতে ১.৬-১১.৭ বোর ম্যাগনেটন। কোবাল্টের আপেক্ষিক ভেদনক্ষমতা লোহার দুই-তৃতীয়াংশ। ধাতব কোবাল্টের দুটি স্ফটিকের কাঠামো আছে: এইচ.সি.পি এবং এফ.সি.সি। এইচ.সি.পি এবং এফ.সি.সি কাঠামোর মধ্যে আদর্শ রূপান্তর তাপমাত্রা ৪৫০° সেলসিয়াস (৮৪২° ফারেনহাইট)। তবে বাস্তবে এগুলির মধ্যে শক্তির পার্থক্য এত কম যে দুটির এলোমেলো আন্তঃরূপান্তর ঘটে।
কোবাল্ট একটি দুর্বল জারক পদার্থ যা একটি নিষ্ক্রিয় অক্সাইড আবরণ দ্বারা সুরক্ষিত থাকে। এটি হ্যালোজেনসমূহ ও সালফার দিয়ে আক্রান্ত হয়। কোবাল্ট দহন বিক্রিয়ায় কোবাল্ট(II, III) অক্সাইড (Co3O4) তৈরি করে যা ৯০০° সেলসিয়াস তাপমাত্রায় অক্সিজেন হারিয়ে কোবাল্ট মনোক্সাইড (CoO) তৈরি করে। এটি ২৪৭° সেলসিয়াস তাপমাত্রায় ফ্লোরিনের (F2) সাথে বিক্রিয়া করে কোবাল্ট(III) ফ্লোরাইড (CoF3) তৈরি করে। ক্লোরিন, ব্রোমিন ও আয়োডিনের সাথে বিক্রিয়া করে কোবাল্ট(III) হ্যালাইড তৈরি করে। এটি হাইড্রোজেন বা নাইট্রোজেনের সাথে উত্তপ্ত অবস্থাতেও বিক্রিয়া করেনা। কিন্তু এটি বোরন, কার্বন, ফসফরাস, আর্সেনিক এবং সালফারের সাথে বিক্রিয়া করে। সাধারণ তাপমাত্রায় এটি অজৈব এসিডের সাথে ধীরে ধীরে বিক্রিয়া করে এবং খুব ধীর গতিতে আর্দ্র বায়ুর সাথে বিক্রিয়া করলেও শুষ্ক বায়ুর সাথে বিক্রিয়া করেনা।
যৌগসমূহ
কোবাল্টের সাধারণ জারণ সংখ্যা +২ ও +৩। যদিও -২ থেকে +৫ জারণ সংখ্যার যৌগও পাওয়া যায়। সরল যৌগে কোবাল্টের সাধারণ জারণ সংখ্যা +২। এই লবণগুলো পানিতে ধাতব-জলীয় জটিল যৌগ [Co(H2O)6]2+ তৈরি করে। ক্লোরাইডের সংযুক্তি যৌগকে গাঢ় নীল রং [CoCl4]2− দেয়। বোরাক্স বিড শিখা পরীক্ষায় কোবাল্ট জারণ ও বিজারণ শিখায় গাঢ় নীল রং দেখায়।
কোবাল্টের বিভিন্ন যৌগের মধ্যে অক্সিজেন ও চালকোজেন যৌগ, হ্যালাইড, জৈব-ধাতব যৌগ এবং সন্নিবেশ যৌগসমূহ উল্লেখযোগ্য।
অক্সিজেন এবং চালকোজেন যৌগসমূহ
কোবাল্টের বেশ কয়েকটি অক্সাইড পরিচিত। সবুজ কোবাল্ট(II) অক্সাইডের (CoO) সৈন্ধব লবণের মতো কাঠামো রয়েছে। এটি পানি ও অক্সিজেনের সাথে জারিত হয়ে বাদামী কোবাল্ট(III) হাইড্রোক্সাইডে (Co(OH)3) পরিণত হয়। ৬০০-৭০০° সেলসিয়াস তাপমাত্রায় কোবাল্ট(II) অক্সাইড জারিত হয়ে রুবির মতো কাঠামোযুক্ত কোবাল্ট(III) অক্সাইড (Co3O4) তৈরি করে। কালো কোবাল্ট(III) অক্সাইডও (Co2O3) পরিচিত। কোবাল্টের অক্সাইডগুলো নিম্ন তাপমাত্রায় বিপরীত-ফেরোচুম্বকীয়। যেমন: কোবাল্ট(II) অক্সাইডের নীল তাপমাত্রা ৫৬৪° সেলসিয়াস এবং কোবাল্ট(III) অক্সাইডের নীল তাপমাত্রা ৩১৩° সেলসিয়াস। কোবাল্ট(III) অক্সাইড ম্যাগনেটাইটের(Fe3O4), এর সমগোত্রীয় যাতে +২ এবং +৩ জারণ অবস্থা মিশ্রিত থাকে।
কোবাল্টের প্রধান চালকোজেনাইডগুলির মধ্যে রয়েছে কোবাল্ট(III) সালফাইড(Co2S3) এবং কালো কোবাল্ট(II) সালফাইড(CoS2) যা পাইরেট জাতীয় কাঠামো গ্রহণ করে।
হ্যালাইডসমূহ
কোবাল্ট(II) এর চারটি পরিচিত ডাইহ্যালাইড হল কোবাল্ট(II) ফ্লোরাইড (CoF2, গোলাপী), কোবাল্ট(II) ক্লোরাইড (CoCl2, নীল), কোবাল্ট(II) ব্রোমাইড (CoBr2, সবুজ), কোবাল্ট(II) আয়োডাইড (CoI2), নীলচে কালো)। এই হ্যালাইডগুলি অজলীয় এবং জলীয় আকারে বিদ্যমান থাকতে পারে। যেখানে অজলীয় ডাইক্লোরাইড নীল এবং জলীয়টি লাল বর্ণের।
Co3++ e− → Co2+
এই বিক্রিয়ার বিজারণ বিভব +১.৯২ ভোল্ট। কিন্তু ক্লোরিণ থেকে ক্লোরাইডের জন্য যার মান +১.৩৬ ভোল্ট। ফলস্বরূপ কোবাল্ট(III) বিজারিত হয়ে কোবাল্ট(II) পরিণত হয়। কারণ ফ্লোরিন থেকে ফ্লোরাইডের বিজারণ বিভবের মান অনেক বেশি, +২.৮৭ ভোল্ট। সাধারণ কোবাল্ট(III) যৌগগুলির মধ্যে স্থিতিশীল একটি হল কোবাল্ট(III) ফ্লোরাইড। কোবাল্ট(III) ফ্লোরাইড কিছু ফ্লোরিনেশন বিক্রিয়াতে ব্যবহৃত হয়, এবং এটি পানির সাথে তীব্রভাবে বিক্রিয়া করে।
সন্নিবেশ যৌগসমূহ
সব ধাতুর মতোই কোবাল্টের আণবিক যৌগগুলি এবং পলিঅ্যাটমিক আয়নগুলিকে সন্নিবেশ যৌগ হিসাবে শ্রেণীবদ্ধ করা হয়। অর্থাৎ অণু বা আয়নগুলোতে বিভিন্ন লিগ্যান্ডের সাথে যুক্ত কোবাল্ট রয়েছে। লিগ্যান্ডের তড়িৎ ঋণাত্মকতা এবং কঠোরতা-নমনীয়তার নীতিগুলো: কোবাল্টের সাধারণ জারণ অবস্থা ব্যাখ্যা করার কাজে ব্যবহার করা যেতে পারে। উদাহরণস্বরূপ Co+3 কমপ্লেক্সগুলোতে অ্যা্মিন লিগ্যান্ডের সম্ভাব্যতা থাকে। কেননা ফসফরাস নাইট্রোজেনের চেয়েও নমনীয়, ফসফিন লিগান্ডগুলোতে নমনীয় Co2+ ও Co+ থাকতে পারে; উদাহরণস্বরূপঃ ট্রিস(ট্রাইফিনাইলফসফিন)কোবাল্ট(I)ক্লোরাইড ((P(C6H5)3)3CoCl)। অধিক তড়িৎ ঋণাত্মক (এবং শক্ত) অক্সাইড এবং ফ্লোরাইড Co4+ এবং Co5+ উৎপাদগুলোকে যেমনঃ সিজিয়াম হেক্সাফ্লোরোকোবাল্টেট (Cs2CoF6) এবং পটাসিয়াম পারকোবাল্টেট(K3CoO4)স্থায়িত্ব দান করতে পারে।
সন্নিবেশ রসায়নে নোবেল পুরষ্কারপ্রাপ্ত অগ্রদূত আলফ্রেড ওয়ার্নার পরীক্ষামূলক ভাবে [Co(NH3)6]3+ এ ধরনের সংকেতবিশিষ্ট যৌগসমূহ নিয়ে কাজ করেন। নির্ধারিত সমাণুগুলোর মধ্যে একটি হল কোবাল্ট(III) হেক্সাঅ্যামিন ক্লোরাইড। এই সাধারণ ওয়ার্নার-ধরনের একটি সন্নিবেশ যৌগ। এতে কেন্দ্রীয় কোবাল্ট পরমাণু ছয়টি অ্যামিন লিগ্যান্ডের সাথে সমকোণীয় ভাবে এবং তিনটি ক্লোরাইডের বিপরীত অ্যানায়ন দিয়ে সন্নিবেশিত থাকে। অ্যামোনিয়ার জায়গায় চিলেটিং ইথিলিনডাইঅ্যামিন লিগ্যান্ডগুলো ব্যবহার করলে ট্রিস(ইথিলিনডাইঅ্যামিন)কোবাল্ট(III) ([Co(en)3]3+) দেয় যা আলোক সমাণুগুলো সমাধানের জন্য প্রথম সন্নিবেশ যৌগগুলোর মধ্যে একটি ছিল। এটি একটি "তিন-মুখযুক্ত প্রোপেলার" এর ডান এবং বাম-আবর্তী রূপে বিদ্যমান। এটি সর্বপ্রথম ওয়ার্নার দ্বারা হলুদ-সোনালী সুইজাতীয় স্ফটিক হিসাবে পৃথক করা হয়েছিল।
জৈব-ধাতব যৌগসমূহ
কোবাল্টোসিন ফেরোসিনের কাঠামোগত অনুরূপ, যাতে লোহার পরিবর্তে কোবাল্ট থাকে। কোবাল্টোসিন ফেরোসিনের চেয়ে জারণে অনেক বেশি সংবেদনশীল। কোবাল্ট কার্বোনিল(Co2(CO)8) কার্বনিলেশন এবং হাইড্রোসিলিলেশন বিক্রিয়াগুলির অনুঘটক। ভিটামিন বি১২ প্রকৃতিতে প্রাপ্ত একটি জৈব-ধাতব যৌগ। এটিই একমাত্র ভিটামিন যাতে ধাতু পরমাণু থাকে। কোবাল্টের বিরল +৪ জারণ অবস্থার একটি অ্যালকাইলকোবাল্ট কমপ্লেক্সের উদাহরণ হলো হোমোলেপটিক কমপ্লেক্স “টেট্রাকিস(১-নর্বোরনাইল) কোবাল্ট(IV)” (Co(1-norb)4), একটি অবস্থান্তর ধাতব-অ্যালকাইল কমপ্লেক্স যা বেটা-হাইড্রোজেন অপসারণে স্থায়িত্বের জন্য উল্লেখযোগ্য। কোবাল্ট(III) এবং কোবাল্ট(V) এর [Li(THF)4]+[Co(1-norb)4]− এবং [Co(1-norb)4]+[BF4]− কমপ্লেক্স গুলোও পরিচিত।
আইসোটোপসমূহ
৫৯Co হল কোবাল্টের একমাত্র স্থিতিশীল আইসোটোপ, যা পৃথিবীতে প্রাকৃতিকভাবে বিদ্যমান। এছাড়াও বাইশটি তেজস্ক্রিয় আইসোটোপ চিহ্নিত করা হয়েছে; সর্বাধিক স্থিতিশীল ৬০Co এর অর্ধজীবন ৫.২৭১৪ বছর, ৫৭Co এর ২৭১.৮ দিন, ৫৬Co এর ৭৭.২৭ দিন এবং ৫৮Co এর ৭০.৮৬ দিন। কোবাল্টের অন্যসব আইসোটোপগুলোর অর্ধজীবন ১৮ ঘণ্টার চেয়ে কম এবং বেশিরভাগ ক্ষেত্রে তা ১ সেকেন্ডেরও কম হয়। কোবাল্টের ৪ টি মাধ্যমিক অবস্থা রয়েছে, যাদের অর্ধজীবন ১৫ মিনিটের চেয়ে কম।
কোবাল্টের আইসোটোপগুলোর পারমাণবিক ভর ৫০ থেকে ৭৩ পর্যন্ত হয়। ৫৯ এর চেয়ে কম ভরের আইসোটোপগুলোর ক্ষয় সাধারণত ইলেক্ট্রন ক্যাপচারের মাধ্যমে হয়। আর বাকিগুলোতে বিটা রশ্মির বিকিরণ ঘটে। ৫৯Co এর নিচে প্রাথমিক ক্ষয়ের পণ্যগুলি হল লোহার বিভিন্ন আইসোটোপ। বাকিগুলোর ক্ষেত্রে সাধারণত নিকেলের বিভিন্ন আইসোটোপ তৈরি হয়।
ইতিহাস
কোবাল্ট যৌগগুলো শতাব্দী ধরে কাঁচ, সিরামিক ও পালিশে উজ্জ্বল নীল রং ফুটিয়ে তোলার জন্য ব্যবহৃত হচ্ছে। মিশরের ভাস্কর্য, পারস্যের অলংকারে এবং চীনে কোবাল্ট চিহ্নিত করা হয়েছে।
ব্রোঞ্জ যুগ থেকেই কোবাল্ট কাঁচ রঙিন করতে ব্যবহৃত হচ্ছে। মিশরের নীল কাঁচ রঙিন করা হতো তামা, লোহা বা কোবাল্ট দিয়ে। সবচেয়ে পুরাতন কোবাল্ট দিয়ে রাঙানো কাঁচ মিশরের ১৮তম রাজবংশ থেকে পাওয়া যায়। মিশরীয়দের ব্যবহৃত কোবাল্টের উৎস জানা যায়নি।
কোবাল্ট শব্দটি জার্মান 'Kobalt' থেকে এসেছে। যা 'Kobold' থেকে নেয়া হয়ছে যার অর্থ 'অপদেবতা', একটি কুসংস্কারাচ্ছন্ন শব্দ যে নামে কোবাল্টের আকরিককে খননকারীরা ডাকত। প্রথমবার নিকেল ও তামার আকরিক বিগলনের মাধ্যমে কোবাল্ট আহরণের চেষ্টা ব্যর্থ হয়েছিলো। এতে শুধু কোবাল্ট(II) অক্সাইডের গুঁড়া পাওয়া গেছিলো। কেননা কোবাল্টের প্রাথমিক আকরিকে সবসময় আর্সেনিক থাকতো। বিগলনে আর্সেনিক জারিত হয়ে খুবই বিষাক্ত ও উদ্বায়ী আর্সেনিক অক্সাইড তৈরি করতো, যা আকরিকের দুর্নাম বয়ে আনে।
সুইডিশ রসায়নবিদ জর্জ বার্ন্ডটকে (১৬৯৪-১৭৬৮) কোবাল্ট আবিষ্কারের কৃতিত্ব দেয়া হয়। ১৭৩৫ সালে তিনি দেখান এটি একটি অজানা (তখনকার) উপাদান, যা বিসমাথ ও অন্যান্য প্রচলিত ধাতু থেকে আলাদা ছিলো। তিনি একে অর্ধ-ধাতু (Semi-metal) নতুন নাম দেন। তিনি দেখান যে কোবাল্টের যৌগগুলোই কাঁচের নীল রংয়ের উৎস; যাকে পূর্বে কোবাল্টের সাথে প্রাপ্ত বিসমাথের জন্য বলে মনা করা হতো। প্রাগৈতিহাসিক কালের প্রথম আবিষ্কৃত ধাতু কোবাল্ট।
অন্য সব জানা ধাতুর (লোহা, তামা, রূপা, সোনা, দস্তা, টিন, লেড ও বিসমাথ) আবিষ্কারের সংরক্ষিত ইতিহাস নেই।
১৯ শতাব্দীতে বৈশ্বিক উৎপাদনের উল্লেখযোগ্য পরিমাণ কোবাল্ট ব্লু এবং স্মাল্ট (কোবাল্ট গ্লাসের গুঁড়া, যা সিরামিক ও চিত্রশিল্পে রঞ্জক পদার্থ হিসেবে ব্যবহৃত হয়) নরওয়ের ব্লাফারভেভায়ার্কেটে। স্মাল্ট উৎপাদনের প্রথম খনিগুলো নরওয়ে, সুইডেন, সাক্সোনি এবং হাংগেরি তে ছিলো। ১৮৬৪ সালে নিউ ক্যালিডোনিয়াতে কোবাল্ট আকরিক আবিষ্কারের পর ইউরোপে কোবাল্ট উত্তোলন হ্রাস পায়। ১৯০৪ সালে কানাডার অন্টারিওতে কোবাল্ট আকরিকের আবিষ্কার এবং ১৯১৪ সালে কঙ্গোর কাতাঙ্গা প্রদেশের এর চেয়েও বড় সঞ্চয়ের সন্ধানের ফলে কোবাল্ট উত্তোলন বাণিজ্য আবার স্থানান্তরিত হয়। ১৯৭৮ সালে সাবা দ্বন্দ্ব শুরু হবার পর কাতাঙ্গা প্রদেশের কাছাকাছি অঞ্চলের তামা খনিগুলো বন্ধ হয়ে যায়। বৈশ্বিক কোবাল্ট অর্থনীতিতে এই দ্বন্দ্বের প্রভাব ধারনার চেয়ে কমই ছিলো। কোবাল্ট একটি দুর্লভ ধাতু, এর রঞ্জক অনেক বিষাক্ত এবং এর মধ্যেই কোবাল্ট সামগ্রী পুনঃব্যবহার উপযোগী করার জন্যে শিল্পকারখানা সফলভাবে স্থাপিত হয়েছে। কিছু ক্ষেত্রে কারখানা কোবাল্ট মুক্ত বিকল্পের পরিবর্তনে সফল হয়েছিল।
১৯৩৮ সালে, জন লিভিংগুড এবং গ্লেন টি. সিবার্গ কোবাল্ট-৬০ তেজক্সিয় আইসোটোপ আবিষ্কারে সফল হয়। এ আইসোটোপ ১৯৫০ এর দশকে কলম্বিয়া বিশ্ববিদ্যালয়ে তেজস্ক্রিয় বিটা ক্ষয়ের সমতা লঙ্ঘন প্রতিষ্ঠায় চমৎকারভাবে ব্যবহৃত হয়।
দ্বিতীয় বিশ্বযুদ্ধের পর, যুক্তরাষ্ট্র সামরিক ব্যবহারের জন্য কোবাল্ট সরবরাহ নিশ্চিত করতে চায় এবং যুক্তরাষ্ট্রের সীমানার ভিতরেই অনুসন্ধান চালায়। ইদাহতে, একটি পাহাড়ের পাশে ব্ল্যাকবার্ড গিরিখাতে কাছের আকরিকের পর্যাপ্ত সরবরাহ পাওয়া যায়। কেলেরা মাইনিং কোম্পানি এখানে উৎপাদন করা শুরু করে।
এটা নিয়ে বিতর্ক আছে যে কোবাল্ট ভৌগোলিক রাজনৈতিক প্রতিযোগিতায় বিশ্বে অন্যতম একটি প্রধান উপাদান হবে যা নবায়নযোগ্য শক্তির উপর চলছে এবং নির্ভর করছে ব্যাটারির উপর। কিন্তু, এই ধারণা বর্ধিত উৎপাদনের অর্থনৈতিক উদ্দীপক শক্তিকে ছোট করে দেখায় সমালোচিতও হয়েছে।
প্রাপ্তিস্থান
স্থিতিশীল অবস্থার কোবাল্ট সুপারনোভা থেকে আর(r)-পদ্ধতিতে তৈরি হয়। ভূত্বকে ০.০০২৯% কোবাল্ট বিদ্যমান। বাতাসের অক্সিজেন এবং সাগরের ক্লোরিনের কারণে মুক্ত কোবাল্ট সাধারণত পাওয়া যায়না। অক্সিজেন ও ক্লোরিন ভূত্বকে প্রচুর পরিমাণে থাকে যা মুক্ত কোবাল্ট তৈরিতে বাঁধা দেয়। সম্প্রতি আবিষ্কৃত ক্ষণপ্রভ লোহা ব্যতীত, প্রচলিত ধাতুগুলোর মতো কোবাল্টকে বিশুদ্ধ অবস্থায় পাওয়া যায়না। উপাদানটির প্রাচুর্যতা মধ্যম পর্যায়ের। কিন্তু কোবাল্টের প্রাকৃতিক যৌগ অনেক এবং অল্প পরিমাণে কোবাল্ট যৌগ শিলা, মাটি, উদ্ভিদ এবং প্রাণীতেই বেশিরভাগ পাওয়া যায়।
প্রকৃতিতে কোবাল্টকে সচরাচর নিকেলের সাথে যুগ্ম অবস্থায় দেখা যায়। উভয়েই ক্ষণপ্রভ লোহার বৈশিষ্ট্যসম্পন্ন উপাদান, যদিও কোবাল্ট সেখানে অল্প পরিমাণে পাআও্যা যায়। নিকেলের মতোই, ক্ষণপ্রভ লোহার সংকরে এটি অক্সিজেন ও আর্দ্র বায়ু থেকে সংকরিত অবস্থায় ভালভাবে সুরক্ষিত থাকে। যদিও প্রাচীন আকরিক গুলোতে নিকেল বা কোবাল্ট কোনোটিই এ অবস্থায় দেখা যেতো না।
যৌগিক কোবাল্ট তামা ও নিকেলের খনিতে পাওয়া যায়। এটি প্রধান ধাতব উপাদান যা সালফার ও আর্সেনিকের সাথে যুক্ত হয়ে সালফারযুক্ত কোবাল্টাইট (CoAsS), স্যাফ্রোলাইট (CoAs2), গ্ল্যাকোডট ((Co,Fe)AsS) এবং স্কুটেরিওডাইট (CoAs3) খনিগুলোতে পাওয়া যায়। ক্যাটিয়েরাইট খনি পাইরাইটের মতোই এবং ভেসাইটের সাথে একসাথে কাতাঙ্গা প্রদেশের তামা খনিতে পাওয়া যায়। বায়ুমণ্ডলের সংস্পর্শে আসলে বিক্রিয়া ঘটে সালফাইড মিনারেল গুলো জারিত হয়ে গোলাপী বর্ণের ইরিথ্রাইট বা কোবাল্ট গ্লেন্স (Co3(AsO4)2·8H2O) ও স্ফেরোকোবাল্টাইট (CoCO3) তৈরি করে।
তামাকের ধোঁয়াতে কোবাল্ট থাকে। তামাক গাছ সহজেই কোবাল্টের মতো ভারী ধাতু শোষন করে পাতায় জমিয়ে রাখতে পারে।
উৎপাদন
কোবাল্টের প্রধান আকরিকগুলো হলো কোবাল্টাইট, ইরিথ্রাইট, গ্লাওকোডট এবং স্কুটেরিওডাইট। কিন্তু, অধিকাংশ কোবাল্ট প্রস্তুত করা হয় নিকেল ও তামার খনি থেকে উত্তোলনের সময় উপজাত হিসেবে এবং বিগলনের মাধ্যমে।
সাধারণত উপজাত হিসেবেই কোবাল্ট প্রস্তুত করা হয় বলে কোবাল্ট সরবরাহ একটি বাজারে তামা ও নিকেলের অর্থনৈতিক সম্ভাব্যতার উপর ব্যাপকভাবে নির্ভর করে। কোবাল্টের চাহিদা ২০১৭ সালে ৬% বৃদ্ধি পায়।
তামা ও নিকেল থেকে কোবাল্টকে আলাদা করার জন্য কোবাল্টের ঘনমাত্রা ও আকরিকে গঠনের উপর ভিত্তি করে বিভিন্ন পদ্ধতি আছে। একটি হলো ফোর্থ ফ্লটেশন, যাতে সারফেকট্যান্ট আকরিকের বিভিন্ন উপাদানের সাথে যুক্ত হয় ফলে কোবাল্ট আকরিকে সমৃদ্ধ হয়। পরবর্তী প্রচন্ড তাপে আকরিককে কোবাল্ট সালফেটে রূপান্তর করে। তামা ও লোহা জারিত হয়ে অক্সাইডে পরিণত হয়। দ্রুত পানি প্রবাহের ফলে সালফেট এবং আর্সেনেটগুলো বের হয়ে আসে। অবশেষগুলোতে সালফিউরিক এসিড যোগ করলে কপার সালফেটের একটি দ্রবণ পাওইয়া যায়। কোবাল্ট তামার বিগলনে উৎপন্ন ধাতুমল থেকেও সংগ্রহ করা যায়।
উল্লেখিত প্রক্রিয়া গুলো থেকে উৎপন্ন উপজাতগুলোকে কোবাল্ট অক্সাইডে (Co3O4) রূপান্তর করা হয়। এই অক্সাইডগুলোকে বাত্যা চুল্লিতে অ্যালুমিনোথার্মিক বিক্রিয়া কিংবা কার্বন বিজারণের মাধ্যমে কোবাল্ট ধাতুতে রূপান্তর করা হয়।
| দেশ | উৎপাদন | সঞ্চয় |
|---|---|---|
| অস্ট্রেলিয়া | ৫,০০০ | ১,২০০,০০০ |
| কানাডা | ৪,৩০০ | ২৫্০,০০০ |
| কিউবা | ৪,২০০ | ৫০০,০০০ |
| গণতান্ত্রিক কঙ্গো প্রজাতন্ত্র | ৬্৪,০০০ | ৩,৫০০,০০০ |
| মাদাগাস্কার | ৩,৮০০ | ১৫০,০০০ |
| নিউ ক্যালেডোনিয়া | ২,৮০০ | - |
| জাম্বিয়া | ২,৯০০ | ২৭০,০০০ |
| পাপুয়া নিউ গিনি | ৩,২০০ | ৫১,০০০ |
| ফিলিপাইন | ৪,০০০ | ২৮০,০০০ |
| রাশিয়া | ৫,৬০০ | ২৫০,০০০ |
| দক্ষিণ আফ্রিকা | ২,৫০০ | ২৯,০০০ |
| মার্কিন যুক্তরাষ্ট্র | ৬৫০ | ২৩,০০০ |
| অন্যান্য দেশ | ৫,৯০০ | ৫৬০,০০০ |
| বিশ্ব মোট | ১১০,০০০ | ৭,১০০,০০০ |
কোবাল্ট নিষ্কাশন
যুক্তরাষ্ট্র ভূতাত্ত্বিক জরিপের হিসাব মতে পৃথিবীতে ৭,১০০,০০০ মেট্রিক টন কোবাল্ট সংরক্ষিত আছে। গণতান্ত্রিক কঙ্গো প্রজাতন্ত্র বর্তমানে বিশ্বের ৬৩% কোবাল্ট সরবরাহ করে। ২০২৫ সাল নাগাদ এ বাজারের শেয়ার ৭৩% এ পৌঁছাবে যদি গ্ল্যাঙ্কোর প্ল্যাকের মতো খননকারী প্রতিষ্ঠানের পরিকল্পিত সম্প্রসারণ আশানুরূপ ঘটে থাকে। কিন্তু, Bloomberg New Energy Finance এর হিসাব মতে ২০৩০ সাল নাগাদ বৈশ্বিক চাহিদা ২০১৭ এর তুলনায় ১৭ গুণের মত বেড়ে যাবে।
২০০২ সালে কঙ্গোর খনন আইন পরিবর্তনের পরে কঙ্গোর তামা ও কোবাল্ট প্রক্কল্পে নতুন বিনিয়োগ বাড়তে থাকে। গ্লেংকোর মুটান্ডা খনি গত বছর ২৪,৫০০ টন কোবাল্ট সরবরাহ করে। যা কঙ্গো ডি.আর.সির উৎপাদনের ৪০% এবং বৈশ্বিক উৎপাদনের এক-চতুর্থাংশ। গ্লেংকোর কাতাংগা খনন প্রকল্প ভালোভাবেই চলছে এবং ২০১৯ সালে ৩০০,০০০ টন কপার এবং ২০,০০০ টন কোবাল্ট উৎপাদন করবে, গ্লেংকোর হিসাব মতে।
গণতান্ত্রিক কঙ্গো প্রজাতন্ত্র
২০০৫ সালে কোবাল্টের শীর্ষ উৎপাদক ছিল গণতান্ত্রিক কঙ্গো প্রজাতন্ত্রের কাতাঙ্গা প্রদেশের তামার খনিগুলো। ২০০৯ সালে ব্রিটিশ ভূতাত্ত্বিক জরিপটি জানিয়েছিল পূর্বের শাবা প্রদেশটিতে বিশ্বের প্রায় ৪০% মজুদ ছিল। ২০১৫ সালের মধ্যে গণতান্ত্রিক কঙ্গো প্রজাতন্ত্র(ডিআরসি) বিশ্ব কোবাল্ট উৎপাদনের ৬০% সরবরাহ করেছে (৩২,০০০ টন)। প্রতি টনের মুল্য ২০,০০০ থেকে ২৬,০০০ ইউ.এস ডলার। ২০০০ এর গোড়ার দিকে কঙ্গোর অত্যন্ত সহিংস গৃহযুদ্ধের সময় খনির উৎপাদন হ্রাস পেয়েছিল। ২০০২ সালে বিদেশী এবং বহুজাতিক বিনিয়োগকে উৎসাহিত করার জন্য দেশটি মাইনিং কোডে পরিবর্তন করেছিল যাতে গ্লেংকোরসহ বেশ কয়েকটি বিনিয়োগকারীকে আগ্রহী করে তোলে। যা উৎপাদনের সাম্প্রতিক প্রবৃদ্ধির একটা বড় কারণ।
২০১৮ এর ফেব্রুয়ারিতে বৈশ্বিক সম্পদ পরিচালনা সংস্থা অ্যালায়েন্স বার্নস্টেইন ডিআরসিটিকে অর্থনৈতিকভাবে "বৈদ্যুতিক গাড়ি যুগের সৌদি আরব" হিসাবে সংজ্ঞায়িত করেছে, বৈদ্যুতিন যানবাহন চালিত লিথিয়াম-আয়ন ব্যাটারিগুলির জন্য প্রয়োজনীয় কোবাল্ট সংস্থানগুলির কারণে।
৯-ই মার্চ, ২০১৮ তে রাষ্ট্রপ্রধান জোসেফ কাবিলা ২০০২ খনির কোড হালনাগাদ করে রয়্যালটি চার্জ বৃদ্ধি করেন এবং কোবাল্ট ও কল্টানকে "কৌশলগত ধাতু" হিসাবে ঘোষণা করেন।
কানাডা
২০১৭ সালে কিছু অন্বেষণকারী সংস্থা অন্টারিওর কোবাল্ট অঞ্চলে পুরানো রৌপ্য এবং কোবাল্ট খনিগুলি জরিপ করার পরিকল্পনা করেছিল। যেখানে উল্লেখযোগ্য পরিমাণ কোবাল্ট সঞ্চিত রয়েছে বলে ধারণা করা হচ্ছে।কোবাল্ট অঞ্চলের মেয়র বিবৃত করেছন যে কোবাল্টের লোকজন খনির নতুন প্রচেষ্টাটিকে স্বাগত জানিয়েছে এবং উল্লেখ করেন যে স্থানীয় কর্মী্রা শান্তিপূর্ণ ও ইংরেজিভাষী। ভাল পরিকাঠামো সংঘাতপূর্ণ অঞ্চলগুলোর তুলনায় সাজসজ্জার জন্য অতিরিক্ত যন্ত্রাংশ ও অন্যান্য সরবরাহের সহজ সুযোগ করে দেবে।
প্রয়োগ
উচ্চ কর্মক্ষমতাসম্পন্ন সংকর ধাতু তৈরিতে কোবাল্ট অনেক দিন ধরেই ব্যবহৃত হচ্ছে। পুনর্ভরণযোগ্য তড়িৎকোষ তৈরিতেও কোবাল্ট ব্যবহার করা যায়। বৈদ্যুতিক যানবাহনের আবিষ্কার এবং ডি.আর.সির ভোক্তার সাথে সফলতার সম্ভবত বড় লেনদেন রয়েছে তাদের উৎপাদন বৃদ্ধির সাথে। অন্যান্য গুরুত্বপূর্ণ বিষয় হলো ২০০২’র খনন আইন, যা বিদেশি এবং বহুজাগতিক প্রতিষ্ঠান যেমন গ্ল্যাংকরকে ১ম ও ২য় কঙ্গো যুদ্ধ শেষে বিনিয়োগে উৎসাহিত করে।
ধাতুসংকরে
কোবাল্টভিত্তিক সুপার সংকরগুলো ঐতিহাসিকভাবে উৎপাদিত বেশিরভাগ কোবাল্ট গ্রাস করেছে। এই সংকরগুলোর তাপমাত্রা স্থায়িত্ব এদেরকে গ্যাস টারবাইন এবং জেট বিমানের ইঞ্জিনগুলোর টারবাইন ব্লেডগুলির জন্য উপযুক্ত করে তোলে। যদিও নিকেল ভিত্তিক একক-স্ফটিক মিশ্রণগুলো দক্ষতায় ছাড়িয়ে গেছে। কোবাল্ট-ভিত্তিক সংকরগুলো ক্ষয় এবং পরিধান-প্রতিরোধী। যা এগুলোকে টাইটানিয়ামের মতো অর্থোপেডিক ইমপ্লান্ট তৈরি করে যা সময়ের সাথে সাথে হ্রাস পায় না। বিংশ শতাব্দীর প্রথম দশকে স্টেলাইট সংকরের মাধ্যমে পরিধান-প্রতিরোধী কোবাল্ট মিশ্রণের বিকাশ শুরু হয়েছিল, যাতে বিভিন্ন পরিমাণ টাংস্টেন এবং ক্রোমিয়াম ছিলো। টাংস্টেন এবং ক্রোমিয়াম কার্বাইডযুক্ত সংকরগুলো খুবই শক্ত এবং পরিধান-প্রতিরোধী।
ব্যাটারীতে
লিথিয়াম কোবাল্ট অক্সাইড(LiCoO2) লিথিয়াম আয়ন ব্যাটারি ক্যাথোডে বহুল ব্যবহৃত হয়। উপাদানটি কোবাল্ট অক্সাইড স্তরগুলির সাথে লিথিয়াম ইন্টারক্লেটেড দিয়ে গঠিত। ডিচার্জিংয়ের সময় লিথিয়াম লিথিয়াম আয়ন হিসাবে নিঃসৃত হয়। নিকেল-ক্যাডমিয়াম (NiCd) এবং নিকেলের ধাতব হাইড্রাইড(NiMH) ব্যাটারিতেও নিকেলের জারণ ত্বরাণ্বিত করতে সাথে কোবাল্ট রাখা হয়। স্বচ্ছ বাজার গবেষণা ২০১৫ সালে বিশ্বব্যাপী লিথিয়াম-আয়ন ব্যাটারির বাজার ৩০ বিলিয়ন মার্কিন ডলার অনুমান করেছে এবং ২০২৪ সালের মধ্যে তা ৭৫ বিলিয়ন মার্কিন ডলার ছাড়িয়ে যাওয়ার পূর্বাভাস দিয়েছে।
অনুঘটক হিসেবে
কয়েকটি কোবাল্ট যৌগ জারণ অনুঘটক হিসেবে কাজ করে। কোবাল্ট অ্যাসিটেট জাইলিনকে টেরেফথালিক অ্যাসিডে রূপান্তর করতে ব্যবহৃত হয়, যা বৃহৎ পলিমার পলিইথিন টেরিফথ্যালেটের অগ্রদূত। সাধারণ অনুঘটক হলো কোবাল্ট কার্বোক্সিলেট গুলো (কোবাল্ট সাবান হিসাবে পরিচিত)। এগুলি শুকনো তেলের জারণের মাধ্যমে পেইন্ট, বার্নিশ এবং কালিতে "শুকানোর মাধ্যম" হিসাবে ব্যবহার করা হয়। স্টিল-বেল্টেড র্যাডিয়াল টায়ারে স্টিল এবং রাবারের মধ্যে সংযুক্তি দৃঢ় করতে একই কার্বোক্সিলেট গুলো ব্যবহৃত হয়। এছাড়াও তারা পলিয়েস্টার রেজিনে সিস্টেমে ত্বরক হি্সেবে ব্যবহৃত হয়।
রঞ্জক ও শোভাবর্ধনে
উনিশ শতকের আগে কোবাল্ট প্রধাণত রঙ্গক হিসাবে ব্যবহৃত হত। এটি মধ্যযুগ থেকেই স্মাল্ট (নীল রঙের কাঁচ) তৈরিতে ব্যবহৃত হচ্ছে। স্মাল্ট তৈরি করা হতো খনিজ স্মাল্টাইট, কোয়ার্টজ এবং পটাসিয়াম কার্বোনেটের মিশ্রণকে প্রচন্ড তাপে দগ্ধ করে, গলিয়ে। যা কালচে-নীল রংয়ের সিলিকেট গ্লাস দেয় যাকে উৎপাদনের পরে সূক্ষ্ম করা হয়। গ্লাস রঙিন করতে এবং পেইন্টিংয়ের রঞ্জক হিসাবে স্মাল্ট ব্যাপকভাবে ব্যবহৃত হত। ১৯৭০ সালে সোভেন রিনম্যান সবুজ কোবাল্ট এবং ১৮০২ সালে লুই জ্যাক থানার্ড নীল কোবাল্ট আবিষ্কার করেছিলেন। কোবাল্ট পিগমেন্ট যেমন কোবাল্ট ব্লু (কোবাল্ট অ্যালুমিনেট), সেরুলিয়ান ব্লু (কোবাল্ট(II) স্ট্যানিয়েট), সবুজ কোবাল্টর বিভিন্ন বর্ণ (কোবাল্ট(II) অক্সাইড এবং জিংক অক্সাইডের মিশ্রণ) এবং কোবাল্ট বেগুনীর (কোবাল্ট ফসফেট) উচ্চতর রং-স্থিতিশীলতার কারণে এগুলো শিল্পীদের রঞ্জক হিসেবে ব্যবহৃত হয়। অ্যারোলিন (কোবাল্ট হলুদ) এখন বেশিরভাগ জায়গায় হালকা হলুদ রঞ্জক দ্বারা প্রতিস্থাপিত হয়েছে।
তেজস্ক্রিয় আইসোটোপ হিসেবে
কোবাল্ট-৬০(60Co) গামা রশ্মির উৎস হিসাবে কার্যকর কারণ এগুলো নিউট্রনের সাহায্যে বোমাবর্ষণ করে অনুমানযোগ্য পরিমাণে এবং উচ্চ ক্রিয়ায় উৎপাদিত হতে পারে। এটি ১.১৭ এবং ১.৩৩ মেগা ইলেক্ট্রোভোল্ট শক্তির গামা রশ্মি তৈরি করে।
কোবাল্ট বহিরাগত রশ্মি রেডিওথেরাপিতে, চিকিৎসা সরবরাহ ও চিকিৎসার বর্জ্য নির্বীজনকরণে, জীবাণুমুক্তকরণের জন্য খাবারের বিকিরণ চিকিৎসা(শীতল পাস্তুরিকরণ), শিল্প রেডিওগ্রাফি (যেমন ওয়েল্ড অখণ্ডতা রেডিওগ্রাফ), ঘনত্ব পরিমাপ (যেমন কংক্রিটের ঘনত্ব পরিমাপ) এবং ট্যাঙ্কে ব্যবহৃত উচ্চতা সুইচ পূরণ করতে ব্যবহৃত হয়। ধাতুটির সূক্ষ্ম ধূলিকণা তৈরির দুর্ভাগ্যজনক বৈশিষ্ট্য রয়েছে, যা বিকিরণ সুরক্ষা নিয়ে সমস্যা তৈরি করে। রেডিওথেরাপি যন্ত্রগুলি থেকে কোবাল্ট সঠিকভাবে না ফেলার করৎণে তা মারাত্মক বিপদ হয়ে দাঁড়িয়েছে এবং ১৯৮৪ সালে উত্তর আমেরিকাতে সবচেয়ে খারাপ বিকিরণ জনিত দুর্ঘটনা ঘটেছিল। যখন মেক্সিকোর জুয়ারেজের একটি জঙ্কিয়ার্ডে ভুলভাবে কোয়েল্ট-৬০ যুক্ত একটি রেডিওথেরাপি ইউনিটকে বিচ্ছিন্ন করে দেওয়া হয়েছিল।
কোবাল্ট-৬০ এর তেজস্ক্রিয় অর্ধজীবন ৫.২৭ বছর। শক্তি হ্রাসের জন্য রেডিওথেরাপিতে নিয়মিত উৎসটির প্রতিস্থাপনের প্রয়োজন হয় এবং কোবাল্ট মেশিনগুলি আধুনিক রেডিয়েশনের থেরাপিতে রৈখিক ত্বরকযন্ত্রগুলির দ্বারা বৃহৎভাবে প্রতিস্থাপন করা হয়েছিল। কোবাল্ট-৫৭ একটি কোবাল্ট তেজস্ক্রিয় আইসোটোপ যা প্রায়শই চিকিৎসাক্ষেত্রে পরীক্ষা নীরিক্ষায় ব্যবহৃত হয়, ভিটামিন বি১২ গ্রহণের জন্য রেডিওল্যাবেল হিসেবে এবং শিলিং পরীক্ষা্য়। কোসাল্ট-৫৭ মসবার বর্ণালীমিতিতে উৎস হিসেবে ব্যবহৃত হয় এবং এক্স-রে ফ্লুরোসেন্স ডিভাইসের অন্যতম সম্ভাব্য উৎস এটি।
পারমাণবিক অস্ত্র ডিজাইনগুলি ইচ্ছাকৃতভাবে কোবাল্ট-৫৯ কে অন্তর্ভুক্ত করতে পারে, যার মধ্যে কিছু পারমাণবিক বিস্ফোরণে সক্রিয় করে 60Co উৎপাদন করে। পারমাণবিক বিস্ফোরণের ফলস্বরূপ ছড়িয়ে ছিটিয়ে থাকা 60Co কে কখনও কখনও কোবাল্ট বোমা বলা হয়।
অন্যান্য ব্যবহার
- কোবাল্টের আকর্ষণীয় বহিঃদর্শন, দৃঢ়তা ও জারণে বাঁধা দেয়ার ক্ষমতার কারণে এটি তড়িৎপ্রলেপনে ব্যবহৃত হয়।
- এটি চীনামাটির বাসন ও মীনা কাজের প্রার্থমিক আবরণ হিসাবেও ব্যবহৃত হয়।
জৈবিক ক্রিয়া
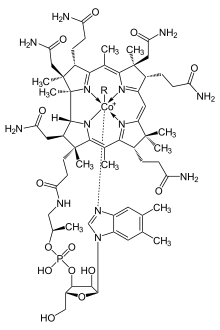
কোবাল্ট সকল প্রাণীর বিপাকীয় কাজের জন্য গুরুত্বপূর্ণ। এটি কোবালামিনের প্রধান উপাদান, যা ভিটামিন বি১২ নামেও পরিচিত। এটি কোবাল্টের জৈবনিক উৎস যা অতি সামান্য পরিমাণে সংরক্ষণ করে। তৃণভোজী প্রাণীদের পাকস্থলীতে উপস্থিত ব্যাকটেরিয়া কোবাল্ট লবণকে ভিটামিন বি১২ এ রূপান্তর করে; যা একমাত্র ব্যাকটেরিয়া এবং আর্কিয়ার সাহায্যেই উৎপাদিত হয়। মাটিতে যৎসামান্য কোবাল্টের উপস্থিতিও তৃণভোজী প্রাণীর স্বাস্থ্যে লক্ষণীয় উন্নতি সাধন করে। কোবাল্টের গ্রহণীয় মাত্রা ০.২০ mg/kg। কেননা তাদের ভিটামিন বি১২ এর অন্য কোনো উৎস নেই।
প্রোটিন ভিত্তিক কোবালামিন কোরিন ব্যবহার করে কোবাল্টকে ধরে রাখে। কোএনজাইম বি১২ এর একটি বিশেষভাবে সক্রিয় C-Co বন্ধন রয়েছে, যা বিক্রিয়ায় অংশগ্রহণ করে। [১০৮] মানবদেহে ২ ধরনের অ্যালকাইল লিগান্ডঃ মিথাইল ও এডিনোসাইল রয়েছে। মিথাইলবি১২মিথাইল গ্রুপ(-CH3) স্থানান্তরকে উৎসাহিত করে। এডিনোসাইলবি১২ পুনর্বিন্যাসকে প্রভাবিত করে হাইড্রোজেনকেসরাসরি নিকটবর্তী দুটি পরমাণুর মাঝে স্থানান্তরিত করে দ্বিতীয় প্রতিস্থাপক, X দিয়ে; যা প্রতিস্থাপকসহ কার্বন, অ্যালকোহলের অক্সিজেন কিংবা অ্যামিন হতে পারে। মিথাইলমেলোনাইল কোএনজাইম-এ মিউটেজ (MUT) MMl-CoA কে Su-CoA তে রূপান্তর করে। যা প্রোটিন ও চর্বি থেকে শক্তি উৎপাদনের একটি গুরুত্বপূর্ণ ধাপ।
অন্যান্য ধাতবপ্রোটিনগুলোর চেয়েও বাকি কোবাল্টোপ্রোটিনগুলো বি১২ এর মতোই পরিচিত। এদের মধ্যে মিথিওনিন অ্যামাইনো পেপ্টাইইডেজ২ মানুষ ও অন্যান্য স্তন্যপায়ী প্রাণীতে পাওয়া যায়। যা বি১২ এর মতো কোরিন রিং ব্যবহার না করে সরাসরি কোবাল্টের সাথে যুক্ত হয়। অন্য একটি কোরিন রিংবিহীন এনজাইম হলো নাইট্রাইল হাইড্রাটেজ, যা ব্যাকটেরিয়াতে থেকে নাইট্রাইলের বিপাকে সহায়তা করে।
প্রাণীদেহে কোবাল্টের অভাবজনিত সমস্যা
বিংশ শতাব্দীর শুরুতে, নিউজিল্যান্ডের দক্ষিণ ভলকানিক প্লাটু দ্বীপে যখন খামারকরণ উন্নতির সময়ে গবাদি পশুরা "গুল্ম অসুস্থতা" রোগে ভুগছিলো। পরীক্ষা করে দেখা যায় ভলকানিক মাটিতে কোবাল্ট লবণের ঘাটতি ছিলো যা গবাদি পশুর খাদ্যচক্রে গুরুত্বপূর্ণ।
১৯৩০ এর দিকে দেখা যায় দক্ষিণ অস্ট্রেলিয়ার দক্ষিণ-পূর্বে অবস্থিত নাইন্টি মাইল ডেসার্ট এলাকায় ভেড়ার "কৌস্ট রোগ" পুষ্টি উপাদানে কোবাল্ট ও তামার অভাবজনিত কারণে হচ্ছে। কোবাল্টের ঘাটতি "কোবাল্ট বুলেট" নামক কোবাল্ট অক্সাইড ও কাদামাটির মিশ্রণে তৈরি ক্ষুদ্র বড়ি দিয়ে পূরণ করা হয়েছিলো।
সতর্কতা
| ঝুঁকি প্রবণতা | |
|---|---|
| জিএইচএস চিত্রলিপি |

|
| জিএইচএস সাংকেতিক শব্দ | বিপদজনক |
| জিএইচএস বিপত্তি বিবৃতি | H317, H334, H413 |
| জিএইচএস সতর্কতামূলক বিবৃতি | P261, P280, P342+311 |
| এনএফপিএ ৭০৪ | |
কোবাল্ট জীবনের জন্য একটি প্রয়োজনীয় উপাদান যা অতি অল্প পরিমাণে দরকার হয়। দ্রবীভূত কোবাল্ট লবণেরজন্য LD50 এর মান ১৫০-৫০০ mg/kg থাকা প্রয়োজন। যুক্তরাজ্যের Occupational Safety and Health Administration (OSHA) প্রতিষ্ঠান কর্মস্থলে অনুমোদনযোগ্য নিঃসরণ মাত্রা (PEL) ০.১ mg/m3, TWA নির্ধারণ করেছে। National Institute for Occupational Safety and Health (NIOSH) সুপারিশকৃত নিঃসরণ মাত্রা (REL) ঠিক করেছে ০.০৫ mg/m3, TWA। Immediately Dangerous to Life and Health (IDLH) মান হলো ২০ mg/m3।
যহোক, লিথাল ডোজের নিচে দীর্ঘস্থায়ী কোবাল্ট গ্রহণ মারাত্মক স্বাস্থ্য সমস্যা তৈরি করে। ১৯৯৬ সালে, বিয়ারের ফেনা দীর্ঘস্থায়ী করার জন্য কোবাল্টযুক্ত যৌগের ব্যবহারের ফলে অদ্ভুত ধরনের টক্সিন প্রভাবিত কার্ডিওমায়োপ্যাথি দেখা যায় যা বিয়ার ড্রিংকার্স কার্ডিওমায়োপ্যাথি নামে পরিচিত।
নিঃশ্বাসের সাথে এটি গ্রহণের ফলে শ্বাসযন্ত্রের সমস্যা তৈরি হয়। এটি স্পর্শ করার ফলে ত্বকের সমস্যাও তৈরি হয়। নিকেল ও ক্রোমিয়ামের পর কোবাল্ট সবচেয়ে বেশি স্পর্শজনিত ত্বকের সমস্যা সৃষ্টির জন্য দায়ী। খনি শ্রমিকেরা এই ঝুঁকিতে থাকে।
কোবাল্ট দগ্ধ শূকরের হাড় দিয়ে সক্রিয়ভাবে শোষিত হয়। এই প্রক্রিয়া তামা ও দস্তা দিয়ে বাঁধাপ্রাপ্ত হয়। কেননা তাদের কোবাল্টের চেয়ে দগ্ধ হাড়ের প্রতি আসক্তি বেশি।
আরও দেখুন
আরও পড়ুন
- "অপদেবতার ধাতু অণ্বেষণঃ কোবাল্টের ব্যবহার চক্র"- পরিবেশ বিজ্ঞান ও প্রযুক্তি
- তুলনামূলক ধাতব-মাটি বিশ্লেষণঃ সুডবারি (অন্টারিও, কানাডা) এবং লুবুম্বশি (কাটাঙ্গা, ডিআর-কঙ্গো)
- ভূগর্ভস্থ পানির রসায়নে পরিত্যক্ত খনি এবং কৃষির সম্মিলিত প্রভাব
- প্রাচীন ধাতুমল থেকে তামা এবং কোবাল্ট পুনরুদ্ধার
- অতিরিক্ত এরিথ্রোসাইটোসিস, দীর্ঘস্থায়ী পর্বতপীড়া এবং সিরাম কোবাল্ট স্তর
- কোবাল্ট খনির কারখানা - ১৮২২-৩২ বিশ্লেষণ।
- নিষিক্ত কানাডিয়ান শিল্ড হ্রদ অববাহিকায় তেজস্ক্রিয় নিউক্লিয়বস্তুর জৈব স্তুপিকরণ
- ধাতব বিষাক্ততা এবং শ্বাস প্রশ্বাসের পথ
- ক্যান্সার সৃষ্টিতে কোবাল্ট, লোহা, সিসা, ম্যাঙ্গানিজ, পারদ, প্ল্যাটিনাম, সেলেনিয়াম এবং টাইটানিয়ামের ভূমিকা
- ক্ষুদ্রতর সোয়াইনের উপর কোবাল্ট ধাতু শ্বাসের সাথে গ্রহনের গবেষণা
বহিঃসংযোগ
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||